Xác định vitamin A-D trong thực phẩm
Xác định vitamin A-D trong thực phẩm
QUY TRÌNH PHÂN TÍCH HÀM LƯỢNG VITAMIN A VÀ VITAMIN D TRONG THỰC PHẨM
1. Vitamin A
Thuật ngữ vitamin A được dùng để chỉ tất cả các hợp chất với hoạt tính sinh học của tất cả các retinol dạng mạch thẳng (R-OH) bao gồm retinal (R-CHO), retinoic acid (R-OOH) và một dạng chiếm chủ yếu trong thực phẩm là các este retinyl (R-OO). Ngoài ra, một dạng tiền chất để tổng hợp vitamin A ở động vật được gọi là carotenoid, một hợp chất tan trong dầu, có màu vàng hoặc cam, hầu như chỉ được tìm thấy ở các loại thực vật. Có khoảng 600 loại carotenoid được tìm thấy trong tự nhiên và hầu hết chúng đều có cấu tạo hóa học là C40H56On, số lượng nguyên tử oxi sẽ thay đổi trong khoảng từ 0 đến 6 (West & Darnton-Hill, 2008).

Hình 1.1 Cấu trúc hóa học của các retinoid mang hoạt tính vitamin A
và các carotenoid phổ biến nhất trong tự nhiên (West & Darnton-Hill, 2008)
Vitamin A là một chất dinh dưỡng thiết yếu, nắm vai trò quan trọng như một chất nền trong quá trình sản xuất tại các tế bào khác nhau. Retinol còn là hợp chất cần thiết trong quá trình sinh tổng hợp rhodopsin và sản xuất retinoic acid (Ross, 2010).
Retinoic acid (là một chất chuyển hóa từ vitamin A) đã được công nhận là một trong những nhân tố quan trọng trong việc hỗ trờ duy trì sự khỏe mạnh các tế bào và các mô trong cơ thể. Retinoic acid có khả năng điều chỉnh sự tăng trưởng của tế bào, làm chậm tốc độ chu kì của tế bào, từ đó điều chỉnh sự phân hóa của tế bào theo một hướng có chọn lọc và an toàn hơn, tránh gây ra sự đột biến trong tế bào là tác nhân chính dẫn đến căn bệnh ung thư. Do đó retinoic acid có chức năng như một cơ quan điều chỉnh các chức năng của tế bào tại tất cả các mô trong cơ thể, hỗ trợ giảm tỉ lệ mắc bệnh ung thư trên cơ thể người (Ross, 2010).
Vì vậy, vitamin A là một chất dinh dưỡng không thể thiếu đối với con người. Vitamin A cần thiết trong việc điều chỉnh nhiều quá trình sinh học trong cơ thể gồm các quá trình hình thành, tăng trưởng, phát triển thị lực, sinh sản và miễn dịch của con người. Việc thiếu hụt vitamin A trong cơ thể lâu dài có thể gây ra các vấn đề về mắt như gây viêm mắt, mù lòa hay gây ra các ca tử vong sớm ở trẻ em do tiêu chảy, sởi, sốt rét hoặc nhiễm trùng ở trẻ (West & Darnton-Hill, 2008).
2 Vitamin D
Vitamin D là một vitamin cần thiết cho sự phát triển của các động vật bậc cao và đặc biệt là con người. Vitamin D là một trong những thành phần điều hòa sinh học quan trọng nhất trong quá trình chuyển hóa calcium trong cơ thể người (Norman, 2012).
Vitamin D được tổng hợp trên da người khi tiếp xúc và được tác động dưới tia cực tím trong ánh nắng mặt trời hoặc có thể được hấp thu qua thực phẩm, đặc biệt là mỡ cá.
Quá trình chuyển hóa vitamin D trong cơ thể: vitamin D sau khi được dung nạp vào cơ thể người sẽ được hydroxyl hóa ở gan thành 25-hydroxyvitamin D (25(OH)D) và sau đó tại thận sẽ được chuyển hóa thành 1,25-dihydroxyvitamin D (1,25(OH)2D), một chất có hoạt tính chuyển hóa có thể thâm nhập vào tế bào, sau đó liên kết với cơ quan thụ cảm vitamin D và sau đó là gen tương ứng trong tế bào chẳng hạn như gen quy định protein liên kết với calcium. Sau khi phiên mã và dịch mã, các protein liên kết với calcium được hình thành. Protein liên kết canxi còn là một chất trung gian cho quá trình hấp thu calcium trong ruột (Lips, 2006).
Vai trò của vitamin đối với sự phát triển của cơ thể con người đặc biệt là trẻ sơ sinh và trẻ nhỏ là rất quan trọng. Việc thiếu hụt vitamin D trong dinh dưỡng về lâu dài có thể gây ra các biến chứng không tốt như gây ra bệnh còi xương hoặc nhuyễn xương, các chất cấu tạo nên bộ xương không được khoáng hóa, khiến cho xương giòn, loãng xương và còn có thể gây tiêu xương dẫn đến xương dễ gãy, ảnh hưởng xấu đến chất lượng cuộc sống, sức khỏe (Lips, 2006).
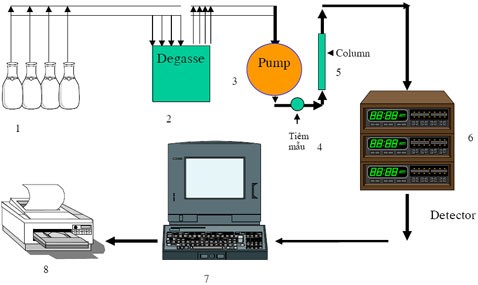
3 PHƯƠNG PHÁP SẮC KÝ LỎNG GHÉP ĐẦU DÒ KHỐI PHỔ HAI LẦN LC-MS/MS
3.1 Tổng quan về sắc ký lỏng (LC)
Sắc ký lỏng là một kỹ thuật phân tích dựa trên nguyên tắc tách một mẫu hỗn hợp thành các phần riêng biệt cấu tạo nên mẫu dựa trên sự khác biệt về ái lực giữa các phân tử khác nhau với pha động và pha tĩnh được sử dụng trong quá trình tách. Phương pháp sắc ký lỏng có ưu điểm là một phương pháp có tính chọn lọc rất cao, có thể định lượng và định tính chất phân tích ở hàm lượng vết, siêu vết trong nhiều nền mẫu khác nhau, thời gian phân tích nhanh, đặc biệt đối với kỹ thuật sắc ký lỏng siêu hiệu năng (ĐINH, 2010).
Một hệ thống sắc ký lỏng điển hình gồm các bộ phận chính:
- Bình đựng dung môi
- Bơm cao áp
- Bộ phận tiêm mẫu
- Cột sắc ký
- Đầu dò
- Bình chứa dịch thải
- Bình đựng dung môi
Bình đựng dung môi chứa dung môi là pha động dùng trong phân tích sắc ký và dùng để phân tách và rửa giải các cấu tử trong hỗn hợp dung dịch mẫu. Dung môi chứa trong bình phải là dung môi tinh khiết phân tích (TKPT, HPLC grade) nhằm đảm bảo an toàn tránh hỏng hóc cho cột sắc ký, hệ thống bơm cao áp và tránh gây nhiễu cho kết quả thu được.
- Bơm cao áp
Bơm sẽ đóng vai trò giúp vận chuyển pha động đi qua bộ phận tiêm mẫu đến cột sắc ký để phân tách mẫu và đi đến đầu dò sau đó được thải vào bình đựng dịch thải. Áp suất của bơm có thể đạt từ 250-1500 bar tùy thuộc vào yêu cầu của từng loại sắc ký lỏng khác nhau (HPLC, UPLC) và trong cấu tạo của bơm sẽ có hai piston nhằm đẩy dung môi liên tục để đạt được lưu lượng bơm từ 0.1-9.999 mL/phút.
- Bộ phận tiêm mẫu
Bộ phận tiêm mẫu sẽ đưa mẫu vào hệ thống đê theo dòng dung môi pha động đi đến cột sắc ký để phân tách. Bộ phận tiêm mẫu có thể là bộ phận tiêm mẫu tự động (Autosample) hoặc tiêm mẫu thủ công bằng tay. Mẫu được tiêm vào hệ thống thường sẽ có thể tích từ 5-100 mL với độ tái lập cao và dưới áp suất cao.
- Cột sắc ký
Cột sắc ký là bộ phận quan trọng nhất trong hệ thống sắc ký lỏng, có thể được xem như là trái tim của một hệ sắc ký, cột sắc ký có vai trò tách các thành phần trong chất cần phân tích thành các phần biệt lập với nhau. Bên trong cột sẽ chứa pha tĩnh thường là vật liệu silica với bề mặt được gắn các nhóm chức khác nhau, có đường kính hạt từ 1.7-10 mm.
Vỏ cột sắc ký thường được làm bằng thép không rỉ, có chiều dài cột từ 50-300 mm với đường kính trong của cột 2-5 mm.
Trong cột sắc ký, khi pha động mang theo chất phân tích đi vào cột, dựa trên ái lực của các thành phần trong mẫu đối với pha tĩnh, thành phần nào tương tác mạnh với pha tĩnh thì sẽ di chuyển chậm hơn và ngược lại. Mỗi thành phần khác nhau sẽ có một lực tương tác khác nhau đối với pha tĩnh, từ đó tách các thành phần ra riêng biệt với nhau trong quá trình chất phân tích di chuyển bên trong cột sắc ký.
- Đầu dò
Đầu dò có vai trò phát hiện và khuếch đại tín hiệu khi các chất được rửa giải ra khỏi cột sắc ký. Tín hiệu từ đầu dò sẽ được thể hiện dưới dạng sắc ký đồ để định tính và định lượng các chất trên sắc ký đồ. Tùy theo tính chất của các chất cần phân tích mà ta sử dụng các loại đầu dò thích hợp, nhằm tối ưu hóa chi phí và độ chính xác mong muốn. Một số loại đầu dò hiện nay thường được sử dụng như đầu dò tử ngoại (UV), huỳnh quang (FLD), khối phổ (MS), đầu dò đo chỉ số khúc xạ (RID)… Trong báo cáo này, khi phân tích đồng thời hàm lượng vitamin A và D trong bột sữa gầy, đầu dò khối phổ hai lần (MS/MS) được sử dụng do ưu điểm về độ nhạy và độ chọn lọc so với các loại đầu dò phổ quát khác.
3.2 Tổng quan về đầu dò khối phổ (MS)
3.2.1 Nguyên lý của khối phổ
Khối phổ là kỹ thuật phân tích đo phổ về khối lượng của các phân tử tích điện khi chúng di chuyển trong điện trường. Phổ khối cung cấp thông tin của chất phân tích bằng cách đo các giá trị tỷ lệ giữa khối lượng và điện tích (m/z) của các mảnh phân tử tích điện (Awad et al., 2015).
Một thiệt bị đo khối phổ sẽ gồm 3 bộ phận chính cấu thành nên:
- Nguồn ion hóa
- Bộ phận tách khối
- Đầu dò
- Nguồn ion hóa
Chất phân tích sau khi đi qua cột sắc ký sẽ được ion hóa thành dạng khí phân tử. Có nhiều dạng ion hóa và mỗi dạng sẽ có những ưu nhược điểm khác nhau phụ thuộc vào tính chất và cấu trúc của chất phân tích như ion hóa phun điện tử (electrospray ionization – ESI) (Hình 2.3), ion hóa hóa học áp suất khí quyển (atmospheric pressure chemical ionization – APCI), ion hóa bằng photon tại áp suất khí quyển (atmospheric pressure photoionization – APPI),..Tuy nhiên với tính chất dễ tương tác với hệ thống sắc ký lỏng hiệu năng cao (HPLC), phù hợp để phân tích khối phổ mẫu phân tích dạng lỏng, thì ion hóa tia điện sẽ được sử dụng trong thí nghiệm này (Awad et al., 2015).

Hình 2 Hệ ion hóa phun điện tử (ĐINH, 2010)
Nguyên lý ion hóa của phương pháp ion hóa tia điện: chất phân tích sẽ được bơm từ cột sắc ký vào hệ thống với tốc độ dòng 1-1000 ml/phút đi qua đầu phun (ống mao quản) có đặt điện áp cao từ 3 đến 6 kV. Sau đó, các giọt mang điện tích rất nhỏ được hình thành sẽ được phun vào khí quyển đi qua một lỗ thông nhỏ có một lớp khí nito được gia nhiệt để tách dung môi hoàn toàn khỏi mẫu phân tích và biến mẫu trở thành các hạt cực kì nhỏ sau đó các hạt sẽ được đưa vào máy đo khối phổ để phân tích khối lượng (Awad et al., 2015).
- Thiết bị phân tích khối
Thiết bị phân tích khối hoạt động dựa trên nguyên tắc: các ion được phân tách dựa trên giá trị m/z (khối lượng chia điện tích) của chúng. Hiện nay có bốn loại thiết bị phân tích khối được sử dụng phổ biến là đầu dò tứ cực (quadrupole (Q)), đầu dò bẫy ion tứ cực (quadrupole ion trap (QIT)), đầu dò thời gian bay (time of flight (ToF)) và đầu dò khối phổ Fourier cộng hưởng cyclotron ion biến đổi (Fourier transform ion cyclotrone resonance (FT-ICR)) (El-Aneed et al., 2009).
Hình 3: Bộ tách khối tứ cực (quadruple) (El-Aneed et al., 2009)
Trong thí nghiệm này, bộ tách khối tứ cực (hình 2.4) sẽ được sử dụng để áp dụng vào phân tích thí nghiệm. Bộ tách khối tứ cực được cấu tạo bởi bốn thanh mang điện tích có tiết diện tròn được đặt song song với nhau. Một dòng điện một chiều sẽ được chạy qua hai trong bốn thanh mang điện, và hai thanh còn lại sẽ được kết nối với điện thế tần số vô tuyến xoay chiều. Các ion sau khi được hình thành trong buồng ion hóa sẽ được phóng vào bộ tách khối tứ cực bởi một điện trường khoảng 5 kV và đi đến bộ phận detector (El-Aneed et al., 2009).Hiện tại, đầu dò khối phổ sử dụng trong thí nghiệm phân tích hàm lượng vitamin A và vitamin D trong bột sữa gầy là đầu dò khối phổ hai lần (Hình 2.6) cũng chính là thiết bị đầu dò ba tứ cực (triple quadruple) (El-Aneed et al., 2009).
Hình 4: Hệ thống đầu dò khối phổ 2 lần (ba tứ cực (triple quadruple)) (El-Aneed et al., 2009)
2.3.3 Phương pháp sắc ký lỏng siêu hiệu năng ghép đầu dò khối phổ hai lần
Sắc ký lỏng ghép đầu dò khối phổ hai lần là một trong những kỹ thuật phân tích liên quan đến quá trình các chất khác nhau trong cùng một mẫu ra khỏi nhau. Kỹ thuật này cho phép ta xác định được từng chất khác nhau và định lượng từng cấu tử trong mẫu thông qua các dung dịch chuẩn và phổ đồ tương ứng của chúng (ĐINH, 2010).
Phương pháp này đã khắc phục được nhược điểm về mức giới hạn cho phép thấp của hệ thống HPLC thông thường, giúp người phân tích có thể xác định được các hợp chất với hàm lượng rất nhỏ. Đồng thời việc ghép khối phổ hai lần cũng khắc phục được những nhược điểm của phương pháp đầu dò khối phổ một lần như không nghiên cứu được cơ chế phân mảnh, sự khác biệt của các đồng phân, không xác định được thêm chi tiết cấu trúc hóa học… (ĐINH, 2010).
Trong những năm gần đây, để cải thiện hiệu suất cho quá trình sắc ký lỏng, việc sử dụng các hạt cho pha tĩnh trong cột có kích thước 1-2 mm đang dần được tiếp cận. Và theo phương trình van Deemter kích thước hạt khi giảm xuống dưới 2 mm không chỉ gia tăng về hiệu suất, mà khi tốc độ dòng chảy tăng lên cũng không làm ảnh hưởng hay làm giảm hiệu suất tách của quá trình. Tuy nhiên để bơm được pha động đi qua một cột dài với các hạt có kích thước rất nhỏ yêu cầu một áp suất bơm rất cao. Nhưng đối với áp suất mà các thiết bị phần cứng của hệ thống sắc ký lỏng hiệu năng cao (HPLC) có thể chịu được (dưới 500 bar) thì chưa đủ để đáp ứng được yêu cầu đổi với kích thước hạt pha tĩnh nhỏ hơn 2 mm. Vì thế hệ thống sắc ký lỏng siêu hiệu năng (UPLC) được phát triển và áp dụng với những ưu điểm như có thể hoạt động ở áp suất rất cao (1000-1500 bar), tăng tốc độ dòng chảy, giảm thời gian phân tích từ đó làm tăng hiệu suất tách các chất trong mẫu và giảm được lượng dung môi cần sử dụng so với hệ thống HPLC (Barceló-Barrachina et al., 2006).
Tuy nhiên để xử lý được các đỉnh rất hẹp được tạo từ hệ thống UPLC, cần sử dụng các loại đầu dò có tốc độ thu thập dữ liệu cao và chính xác như hệ thống khối phổ dựa trên thời gian bay ghép với đầu dò tứ cực hay đầu dò ba tứ cực (triple quadruple) (Barceló-Barrachina et al., 2006).
Qua những điều nêu trên, nhằm đảm bảo hiệu suất tách cao, tốc độ thu thập và xử lý số liệu trên hệ thống được chính xác. Ta sử dụng hệ thống sắc ký lỏng siêu hiệu năng ghép đầu dò khối phổ hai lần để đạt được những kêt quả có độ chính xác mong muốn.

Hình 5 Hệ thống sắc ký lỏng ghép đầu dò khối phổ hai lần LC-MS/MS (NIFC, 2021)
Những thành phần cơ bản của hệ thống LC-MS/MS (ĐINH, 2010):
- Hệ thống bơm (Pump system)
- Hệ thống tiêm mẫu (Injection system)
- Cột sắc ký (pha tĩnh – stationary phase)
- Pha động (mobile phase – (hỗn hợp) dung môi)
- Đầu dò khối phổ (Detector)
- Hệ thống xử lý dữ liệu
2.4 QUY TRÌNH PHÂN TÍCH
2.4.1 Nguyên tắc phương pháp thực hiện
Mẫu bột sữa gầy sẽ được xà phòng hóa bằng ethanol với KOH 50% và chất chống oxi hóa pyrogallic acid để chuyển các chất béo về dạng acid béo và chuyển retinol este về retinol, sau đó sử dụng phương pháp chiết lỏng –lỏng để chiết mẫu, mẫu sau khi chiết được làm bay hơi dung môi chiết. Cuối cùng mẫu được hòa tan lại và phân tích bằng thiết bị LC-MS/MS.
2.4.2 Hóa chất và thuốc thử
- Ethanol (C2H5OH,Merck, độ tinh khiết 99.6%)
- Methanol (CH3OH,Merck, độ tinh khiết 99.9%)
- Acetonitrile (CH3CN,Merck, độ tinh khiết 99.9%)
- Hexane (CH3(CH2)4CH3,Merck, độ tinh khiết 99.0%)
- Potassium hydroxide (KOH, Merck, độ tinh khiết 85.0%)
- Pyrogallic acid (C6H3(OH)3, Merck)
- Nước cất
- Nước khử ion (DIW)
- Dung dịch ethanol chứa 2% acid pyrogallic: hòa tan 10 g acid pyrogallic trong 500 mL ethanol.
- Dung dịch KOH 50% (w/v): cân 500 g KOH rắn, thêm 500 mL nước cất và khuấy đều đến khi tan hết, lưu ý quá trình pha sẽ tỏa nhiều nhiệt cần có phương pháp làm nguội hợp lý.
- Dung dịch rửa tạp KOH 0.15M: hòa tan 0.84 g KOH bằng nước cất sau đó chuyển dung dịch vào bình định mức 100 mL và định mức tới vạch bằng nước cất.
- Dung môi chiết mẫu (n-hexane chứa 12.5 mg/L BHT): cân 125 mg BHT vào bình định mức 100 mL, định mức tới vạch bằng n-hexane. Tiếp tục pha loãng dung dịch 10 lần bằng hexane thu được dung dịch chiết mẫu.
- Dung môi hòa tan mẫu ACN:H2O = 7:3 , v/v: Trộn 70 mL acetonitrile với 30 mL nước.
- Pha động A: nước 20%MeOH 0.1%HCOOH: Trộn 200 mL MeOH với 800 mL nước cất và 1.0 mL HCOOH, lắc đều, lọc qua giấy lọc 0.45 mm, siêu âm đuổi bọt khí khoảng 10 phút trước khi sử dụng.
- Pha động B: MeOH 0.1%HCOOH: rút 1.0 mL HCOOH vào ống đong chứa 1000 mL MeOH, cho vào bình đựng pha động và lắc đều, siêu âm đuổi bọt khí khoảng 10 phút trước khi sử dụng.
- Chuẩn vitamin D2 (ergocalciferol)
- Chuẩn vitamin D3 (cholecalciferol)
- Nội chuẩn vitamin D2 – [2H3] (1mg/mL = 40000 IU/mL), được phối trộn sẵn từ nhà sản xuất
- Nội chuẩn vitamin D3 – [2H3] (1mg/mL = 40000 IU/mL), được phối trộn sẵn từ nhà sản xuất
- Dung dịch nội chuẩn gốc (~1600 IU/mL): chuyển định lượng từng nội chuẩn D2 – [2H3] (1 mg/mL) và D3 – [2H3] (1 mg/mL) vào bình định mức 25 mL, định mức đến vạch bằng ethanol, bảo quản tránh ánh sáng ở -18o
- Hỗn hợp nội chuẩn trung gian (~20 IU/mL): rút lần lượt 1,25 mL dung dịch nội chuẩn gốc (~1600 IU/mL) của vitamin D2 – [2H3] và D3 – [2H3] cho vào bình định mức 100 mL, định mức tới vạch bằng CAN, bảo quản tránh ánh sáng ở -18o
- Chuẩn vitamin A (all-trans retinyl palmitate) 2000 mg/L
2.4.3 Thiết bị và dụng cụ
- Thiết bị
- Thiết bị sắc ký lỏng ghép đầu dò khối phổ hai lần (LC-MS/MS) (Water, ACQUITYTM TQD) gồm:
- Hệ bơm dung môi (Waters, Aquity UPLC Quatemary Sovent Manager)
- Hệ thống tiêm mẫu tự động (Waters, Acquity UPLC H-Class Sample Manager)
- Cột sắc ký (Waters, Acquity UPLC BEH)
- Lò gia nhiệt cột sắc ký (Waters, Acquity UPLC H-Class Column Heater)
- Hệ thống phân tích khối phổ (Waters, Acquity TQ Detector)
- Cân phân tích , độ chính xác 0.0001 g (OHAUS, USA)
- Máy xay mẫu (Máy xay bột khô 2000A, VietNam)
- Bể điều nhiệt (bếp cách thủy) (Biobase, China)
- Bể siêu âm (Bandelin Sonorex Super RK 1028 CH, Germany)
- Thiết bị cô quay chân không ( Dlab RE 100-Pro, USA)
- Máy lắc vortex (Velp ZX4, Italia)
- Dụng cụ
- Màng lọc PTFE 0.45 µm (Membrane Solution, USA)
- Phễu chiết 250 mL, 500 mL (Scilabware, England)
- Pipet thủy tinh các loại (EULAB, Germany)
- Micropipet các loại (ISOLAB, Germany)
- Bình định mức 100 mL (EULAB, Germany)
- Bình cầu 250 mL (EULAB, Germany)
- Một số dụng cụ thí nghiệm thông thường khác.
2.4.4 Chuẩn bị mẫu
- Chuẩn bị mẫu thử
Mẫu khi nhận sẽ được xử lý ngay hoặc bảo quản mẫu trong tủ lạnh không quá 5oC cho đến khi xử lý.
Mẫu bột sữa khi sử dụng sẽ được xay mịn bằng máy xay chuyên dụng và bảo quản trong tủ lạnh không quá 5oC trước khi phân tích.
2.4.4.2 Chuẩn bị chuẩn vitamin D và vitamin A
- Chuẩn vitamin D
Dung dịch chuẩn gốc 1000 mg/L: cân chính xác 10.00 mg từng chất chuẩn vitamin D2, vitamin D3 vào hai bình định mức 10ml. Hòa tan chất chuẩn và định mức đến vạch bằng n-hexane. Chuẩn được bảo quản ở (-18±40)oC, tránh ánh sáng và có thể sử dụng được trong hai tháng.
Hỗn hợp chuẩn trung gian 1 (20 mg/L): rút 0.2 mL từng chuẩn gốc vitamin D2 và vitamin D3 vào ống thủy tinh, thôi khô và hòa tan lại chính xác bằng 10ml ACN. Chuẩn được bảo quản ở (-18±40)oC, tránh ánh sáng và có thể sử dụng được trong hai tháng.
Hỗn hợp chuẩn trung gian 2 (2 mg/L): rút 1 mL dung dịch chuẩn trung gian 1 đã được bảo quản cho vào bình định mức 10 mL, định mức đến vạch bằng ACN. Chuẩn được bảo quản ở (-18±40)oC, tránh ánh sáng và có thể sử dụng được trong hai tháng.
Dung dịch chuẩn làm việc 5.0, 20.0, 50.0 và 200.0 (mg/L) được pha theo bảng 2.4, chuẩn được bảo quản ở (-18±40)oC, tránh ánh sáng và có thể sử dụng được trong hai tháng.
Bảng 2.4 Bảng chuẩn bị dung dịch chuẩn theo từng nồng độ (vitamin D)
| Chuẩn 1 | Chuẩn 2 | Chuẩn 3 | Chuẩn 4 | |
| Nồng độ chuẩn làm việc (D2=D3) (mg/L) | 5.0 | 20.0 | 50.0 | 200.0 |
| Vrút dung dịch chuẩn 2.0 mg/L (mL) | 0.025 | 0.10 | 0.25 | 1.00 |
| Thể tích định mức bằng ACN (mL) | 10 | 10 | 10 | 10 |
- Chuẩn vitamin A
Dung dịch chuẩn gốc 2000 mg/L
Dung dịch chuẩn làm việc 0.5, 2.0, 5.0, 10.0, 40.0 (mg/L) được pha theo bảng 2.5, các dung dịch chuẩn được rút theo đơn vị (mL), chuẩn được bảo quản ở nhiệt độ phòng và sử dụng trong ngày.
Bảng 2.5 bảng chuẩn bị dung dịch chuẩn theo từng nồng độ (vitamin A)
| Chuẩn 1 | Chuẩn 2 | Chuẩn 3 | Chuẩn 4 | Chuẩn 5 | |
| Nồng độ chuẩn làm việc (mg/L) | 0.5 | 2.0 | 5.0 | 10.0 | 40.0 |
| Vrút dung dịch chuẩn 2000 mg/L | – | – | – | – | 0.5 |
| Vrút dung dịch chuẩn 2000 mg/L | – | – | – | 0.25 | – |
| Vrút dung dịch chuẩn 5 (40.0 mg/L) | – | – | 1.25 | – | – |
| Vrút dung dịch chuẩn 5 (40.0 mg/L) | – | 0.5 | – | – | – |
| Vrút dung dịch chuẩn 4 (10.0 mg/L) | 0.5 | – | – | – | – |
| Thể tích định mức bằng ACN (mL) | 10.0 | 10.0 | 10.0 | 50.0 | 25.0 |
2.4.5 Quy trình thực hiện
Quy trình xác định hàm lượng vitamin A và D (Hình 2.7) trên mẫu bột sữa gầy dựa trên AOAC 2016 (2011.11), phương pháp xác định hàm lượng vitamin D trong sữa công thức dành cho trẻ em và người lớn bằng phương pháp sắc ký lỏng siêu hiệu năng ghép đầu dò khối phổ hai lần. Phương pháp được áp dụng và phát triển để phù hợp với những điều kiện máy móc thiết bị và sản phẩm của công ty.
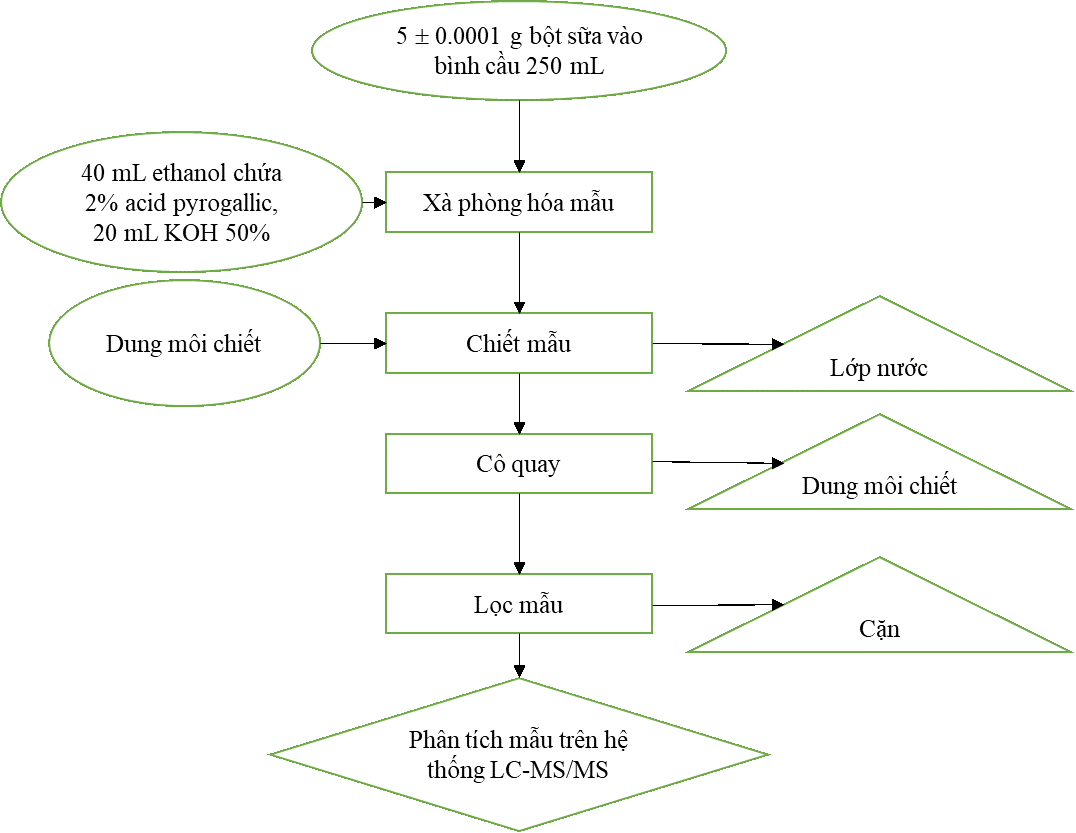
Hình 2.7 Sơ đồ quy trình xác định hàm lượng vitamin A và vitamin D
2.4.6 Thuyết minh quy trình
- Xà phòng hóa mẫu
Cân 5±0.0001 g mẫu bột sữa đã xử lý vào bình cầu 250ml. Sau đó thêm vào bình chứa mẫu 40 mL ethanol có chứa 2% pyrogallic acid và 20 mL KOH 50%. Bình cầu chứa hỗn hợp sau đó được đun trên bếp cách thủy trong 15 phút ở 90oC.
Trong quá trình xà phòng hóa, pyrogallic acid có tác dụng chống oxi hóa nhằm bảo vệ hàm lượng vitamin A và vitamin D trong mẫu không bị oxi hóa vởi oxi trong không khí gây sai lệch kết quả. Bên cạnh đó KOH 50% đóng vai trò tạo môi trường kiềm cho quá trình thủy phân chất béo trong mẫu.
- Chiết mẫu
Hỗn hợp chứa dịch mẫu sau khi được xà phòng hóa sẽ được chuyển toàn bộ vào một phễu chiết 250 mL.
Ở lần chiết thứ nhất ta thêm 50 mL n-hexane (chứa 12.5 mg/L BHT), sau đó lắc đều liên tục trong một phút. Hỗn hợp dung dịch sau đó sẽ tách thành hai lớp gồm một lớp chứa n-hexane ở phía trên và lớp nước ở phía dưới.
Tiếp tục chuyển lớp nước ở phía dưới vào bình cầu dùng để xà phòng hóa mẫu, lớp chứa n-hexane sẽ được chuyển vào một bình cầu khác.
Lớp nước thu lại vào bình cầu ở lần chiêt thứ nhất sẽ tiếp tục được chuyển lại vào phễu chiết đã sử dụng để chiết ở lần chiết thứ nhất, tiếp tục thêm 50 mL n-hexane (chứa 12.5 mg/L BHT), sau đó lắc đều trong một phút và tách lớp nước vào bình cầu xà phòng hóa mẫu, lớp chứa n-hexane sẽ được gộp chung vào bình cầu chứa n-hexane của lần chiết thứ nhất.
Mẫu sẽ được chiết 3 lần, các quy trình giống như lần chiết thứ nhất nhằm đảm bảo chiết hoàn toàn chất phân tích trong mẫu.
- Cô quay và lọc
Lớp chứa n-hexane ở ba lần chiết sẽ được thu lại và gộp chung vào một bình cầu. Hỗn hợp thu được sẽ mang đi cô quay đến khô.
Sau khi cô quay đến khô, thêm 10 mL ACN-H2O (theo tỉ lệ 7:3) để hoa tan chất khô trong bình cầu. Mang hỗn hợp thu được lọc qua màng lọc 0.45 mm và thu lại dịch. Dịch thu được sẽ được dùng để phân tích.
Trong quá trình cô quay, việc cô quay đến khô và hòa tan lượng chất khô trong bình bằng 10 mL ACN-H2O sau đó lọc qua màng lọc mang những ý nghĩa quan trọng hỗ trợ cho quá trình xác định hàm lượng vitamin tiếp theo trên hệ thống sắc ký lỏng ghép đầu dò khối phổ hai lần:
- Làm giàu chất phân tích trong mẫu.
- Pha loãng bằng ACN-H2O giúp hỗn hợp dịch phân tích tương thích với hệ thống, đồng thời dung môi ACN giúp cải thiện hiệu suất ion hoá mẫu ở đầu dò khối phổ.
- Ngoài ra, việc cô quay đến khô và hoà tan lại với dung môi giúp loại bỏ một số tạp chất không tan trong mẫu sau quá trình chiết mẫu.
- Phân tích hàm lượng vitamin A và vitamin D trong mẫu trên hệ thống LC-MS/MS
Điều kiện sắc ký
- Cột sắc ký là cột pha đảo C18 có kích thước 2.1 ´ 100 mm (đường kính ´ chiều dài), hạt silicagel có đường kính là 1.7 m
- Thể tích mẫu tiêm: 20.0 m Thứ tứ tiêm mẫu lần lượt là các chất chuẩn xây dựng đường chuẩn, mẫu blank, mẫu phân tích, chuẩn kiểm tra.
- Nhiệt độ buồng cột: 30oC
- Pha động gồm:
- Pha động A: H2O 20% MeOH chứa 0.1% HCOOH
- Pha động B: MeOH chứa 0.1% HCOOH
- Chương trình pha động theo bảng 2.6
Bảng 2.6 Bảng chương trình pha động cho quá trình sắc ký
| Thời gian (phút) | % Pha động A | % Pha động B | Tốc độ dòng (mL/phút) |
| 0 | 45 | 55 | 0.25 |
| 1 | 45 | 55 | 0.25 |
| 9 | 0 | 100 | 0.4 |
| 15 | 0 | 100 | 0.4 |
| 15.1 | 45 | 55 | 0.4 |
| 17.1 | 45 | 55 | 0.4 |
| 17.2 | 45 | 55 | 0.25 |
| 20 | 45 | 55 | 0.25 |
Điều kiện khối phổ:
- Dạng ion hóa: ion hóa tia điện
- Điện áp: 2500 V
- Điện áp côn: 35 V
- Nhiệt độ nguồn : 140oC
- Nhiệt độ khử solvat hóa: 400oC
- Dòng khí khử solvat hóa: 800 L/h
- Dòng khí cone: 50 L/h
- Dòng khí va chạm: 4.0´10-3 mbar (khí Argon)
Tính kết quả:
Từ đường tuyến tính y = ax + b giữ diện tích peak và nồng độ các dung dịch chuẩn từng dạng vitamin D và vittamin A, nội suy được nồng độ từng dạng vitamin D và vitamin A trong dung dịch mẫu.
Tính được hàm lượng vitamin D và vitamin A trong mẫu thử theo công thức:
X = (CxV)/W
Trong đó:
C: Nồng độ của từng dạng vitamin D và vitamin A từ đường chuẩn (mg/L)
V: thể tích hòa tan mẫu (mL)
W: Lượng mẫu thử (mL)
X: hàm lượng từng dạng vitamin D và vitamin A trong mẫu (mg/L hoặc mg/kg)