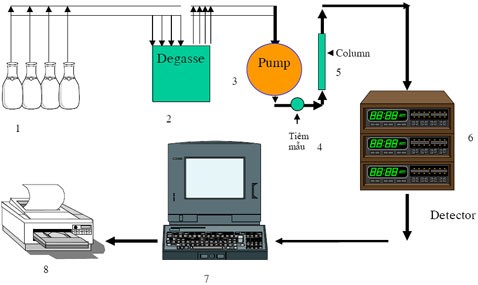
Xác định florua trong nước mặt
-
Định nghĩa Florua
- Florua là một anion hóa vô cơ, đơn phân tử của flovới công thức hóa học F–. Florua là anion đơn giản nhất của flo.
- Florua gây ra sự phá hủy diện rộng mùa màng. Nó chủ yếu được tập trung bởi thực vật ở dạng khí (HF) qua khí khổng của lá, hòa tan vào pha nước hấp thu vào lá. Các triệu chứng thương tổn chung là sự gây vàng đỉnh, mép lá và gây cháy lá. Nó cũng làm giảm sự sinh trưởng phát triển của thực vật và sự nảy mầm của hạt
- Hàm lượng flo cao gây ngộ độc đối với con người. Liều lượng gây tử vong cho người là 0,5 g/kg thể trọng. Florua chủ yếu được tích lũy ở các khớp cổ, đầu gối, xương chậu và xương vai, gây ra sự khó khăn khi di chuyển hoặc đi bộ. Các triệu chứng của xương nhiễm flo tương tự như cột sống dính khớp hoặc viêm khớp, xương sống bị dính lại với nhau và cuối cùng nạn nhân có thể bị tê liệt.
- Nó thậm chí có thể dẫn đến ung thư và cuối cùng là cột sống lớn, khớp lớn, cơ bắp và hệ thần kinh bị tổn hại như: thoái hóa sợi cơ, nồng độ hemoglobin thấp, dị dạng hồng cầu, nhức đầu, phát ban da, thần kinh căng thẳng, trầm cảm, các vấn đề về tiêu hóa và đường tiếp liệu, ngứa ran ở ngón tay và ngón chân, giảm khả năng miễn dịch, xảy thai, phá hủy các enzym.
-
Phương pháp xác định Florua trong nước mặt theo SMEWW 4500-F-. B&C: 2017
- Khi điện cực chọn lọc ion florua tiếp xúc với dung dịch nước có chứa ion florua, sự chênh lệch điện thế giữa điện cực đo và điện cực so sánh tăng lên. Giá trị của sự chênh lệch về điện thế này tỷ lệ với logarit của nồng độ ion florua theo phương trình Nernst.
- Nhiệt độ và nồng độ của ion có thể ảnh hưởng đến sự chênh lệch điện thế. Do đó, các thông số phải giữ nguyên trong suốt quá trình hiệu chuẩn và đo và phải giữ cố định trong suốt quá trình phân tích.
- Hoạt độ của ion florua cũng phụ thuộc vào độ pH. Độ pH giữa 5 và 7 là thích hợp nhất cho phép đo. Các dung dịch đệm đặc biệt được sử dụng để ổn định độ pH và hệ số hoạt tính.
-
Lấy mẫu và bảo quản mẫu cần phân tích florua
- Mẫu được lấy vào bình polyetylen đã rửa và tráng bằng nước không chứa florua. Không cần chất bảo vệ nào, nhưng phân tích càng sớm càng tốt, nên làm trong vòng 3 ngày.
-
Các yếu tố ảnh hưởng đến quá trình phân tích
- Ảnh hưởng của ion chloride: Thêm Ag2SO4 vào bình chưng cất với tỷ lệ 5mg/mgCl- để loại bỏ ảnh hưởng của chloride.
- Nếu đun quá 180oC quá trình chưng cất sẽ kéo theo ion SO42- nên phải điểu chỉnh nhiệt độ sao cho không được xảy ra hiện tượng quá nhiệt để tránh sự ảnh hưởng của Sulfate.
- Fluoride có thể tạo phức với ion sắt và nhôm có trong mẫu. Tuy nhiên, CDTA có trong dung dịch đệm sẽ ưu tiên tạo phức với ion sắt và nhôm, đẩy florua có trong phức thành dạng ion tự do.
- Trong dung dịch axit, F– tạo thành một phức hợp HF-HF bị ion hóa kém, và trong dung dịch kiềm, ion OH– sẽ ảnh hưởng đến điện cực. Vì vậy, dùng đệm duy trì pH để giảm thiểu sự hình thành phức hợp hydro florua và ảnh hưởng của ion OH–.
-
Hóa chất, chất chuẩn
- Nước cất: Nước cất được sử dụng trong tất cả thuốc thử và trong việc pha loãng.
- AgSO4 rắn
- H2SO4 đậm đặc
- Acid acetic băng
- NaOH 6N: Hòa tan 48,24g NaOH trong 200 ml nước
- Dung dịch chuẩn gốc 100mg/L: hòa tan 221,0 mg NaF trong 1000 ml nước cất. Chuẩn gốc này được bảo quản trong chai polyetylen
- Dung dịch chuẩn làm việc 10 mg/L: Hút chính xác 10 ml dung dịch chuẩn gốc và định mức 100 ml với nước cất.
- Dung dịch đệm: Để khoảng 500 ml nước cất vào cốc 1000 ml, thêm 58g NaCl và 4 g 1,2 cyclohexylenediaminetetraacetic acid (CDTA) dùng đũa khuấy cho tan, đặt cốc vào bể nước lạnh, thêm từ từ NaOH 6N và khuấy từ từ cho đến khi pH đạt 5,3 đến 5,5, chuyển dung dịch vào bình định mức 1000ml và định mức tới vạch bằng nước cất. Dung dịch bền trong 6 tháng.
-
Dụng cụ, thiết bị
- Hệ thống chưng cất florua với bình chưng cất 1 L bằng thủy tinh 1L với cổ dài và đáy tròn.
- Bếp đun bình cầu 1 L
- Nhiệt kế có thể đọc đến 200oC
- Điện cực chọn lọc ion florua Metrohm, mã 6.0502.150
- Điện cực so sánh: sử dụng điện cực Ag/AgCl, mã 6.0729.100
- Máy chuẩn độ điện thế Metrohm 848
- Máy khuấy từ IKA
- Bình định mức nhựa 100 ml
- Các dụng cụ thủy tinh cơ bản trong phòng thí nghiệm
-
Quy trình chưng cất mẫu
- Thêm 400 ml nước vào bình chưng cất, thêm từ từ 200 ml acid H2SO4 đậm đặc. Thêm một vài hạt thủy tinh mềm và kết nối các bộ phận của hệ thống chưng cất. Tiếp tục đun nóng cho đến khi đạt 180oC (cần phải ngưng khi nhiệt độ đạt 178oC để ngăn ngừa sự quá nhiệt), để nguội đến nhiệt độ 80o Thêm 250 ml mẫu gia nhiệt cho đến khi nhiệt độ đạt 180oC (tắt gia nhiệt đến khi đạt 178oC). Duy trì nhiệt độ 180oC. Kết thúc chưng cất cho đến khi lượng mẫu hứng được ở bình ngưng đạt 250 ml.
- Thêm Ag2SO4 vào bình chưng cất với tỷ lệ 5mg/mgCl– để loại bỏ ảnh hưởng của chloride.
- Có thể sử dụng lại dung dịch H2SO4 trong bình đã chưng cất nhiều lần cho đến khi các chất gây ô nhiễm từ các mẫu tích lũy ảnh hưởng đến khả năng phục hồi hoặc các chất cản trở xuất hiện trong sản phẩm chưng cất. Kiểm tra lại sự phù hợp của acid định kỳ bằng cách chưng cất các mẫu florua chuẩn và phân tích hàm lượng cả fluoride. Sau khi phân tích, nếu mẫu có chứa nhiều hơn 3 mgF–/L, rửa sạch bằng cách thêm 300ml nước cất, chưng cất lại. Nếu cần, lặp lại qui trình chưng cất cho đến khi hàm lượng fluoride của sản phẩm chưng cất cuối cùng ở mức tối thiểu.
-
Quy trình phân tích
- Lập đường chuẩn
- Chuẩn bị dãy nồng độ theo bảng sau:
| STT | 0 | 1 | 2 | 3 | 4 | 5 |
| V 5 mg/L (ml) | 0 | 1 | 2 | 10 | 20 | 40 |
| Nước cất | Định mức 100 ml | |||||
| C (µg/ml) | 0 | 0,05 | 0,1 | 0,5 | 1,0 | 2,0 |
- Thêm 25 ml chuẩn và 25 ml đệm vào cốc 100 ml, ngâm điện cực và đo điện thế trong quá trình khuấy mẫu bằng máy khuấy từ. Tránh khuấy trước khi nhúng điện cực, sau 3 phút hoặc sau khi giá trị không thay đổi tiến hành ghi nhận milivol cuối cùng. Vẽ đồ thị tương quan giữa logrit nồng độ và milivol đo được E = Log(C).a + b
- Phân tích mẫu
Thêm 25 ml mẫu đã chưng cất theo mục 8. và 25 ml đệm vào cốc 100 ml, ngâm điện cực và đo điện thế trong quá trình khuấy mẫu bằng máy khuấy từ. Tránh khuấy trước khi nhúng điện cực, sau 3 phút hoặc sau khi giá trị không thay đổi tiến hành ghi nhận milivol cuối cùng.
- TÍNH TOÁN KẾT QUẢ
Dựa vào đường chuẩn để tính nồng độ florua trong mẫu nước phân tích.
Trong đó:
- C: Nồng độ Florua trong mẫu (mg/L)
- E: điện thế đo được (milivol)
- b,a: hệ số phương trình hồi quy tuyến tính
- F : hệ số pha loãng (nếu có)
- KIỂM SOÁT CHẤT LƯỢNG
Thực hiện kiểm soát chất đối với mẫu như sau:
- Mẫu trắng phòng thí nghiệm (LB: Laboratory Blank)
Phân tích ít nhất một mẫu trắng trong mỗi lần thực hiện phân tích. Đánh giá kết quả dựa vào giới hạn 0 ± 0,023 mg/L.
Nếu mẫu trắng ngoài giới hạn kiểm soát, kiểm tra xem dụng cụ, hoá chất, chất chuẩn có bị nhiễm bẩn không. Nếu bị nhiễm bẩn, làm sạch dụng cụ thủy tinh bằng H2SO4 loãng. Kiểm tra chất lượng nguồn nước của phòng thí nghiệm. Sử dụng hóa chất và chất chuẩn mới nếu thấy cần thiết.
- Mẫu kiểm soát chất chất lượng (QCS: Quality Control Sample)
Phân tích ít nhất một mẫu QCS nồng độ 0,2 mg/L trong mỗi lần thực hiện phân tích. Đánh giá kết quả dựa vào biểu đồ kiểm soát chất lượng.
Dung dịch QCS nồng độ 0,2 mg/L được chuẩn bị từ dung dịch làm việc QCS 5 mg/L.
Nếu mẫu QCS nằm ngoài giới hạn kiểm soát, kiểm tra xem dụng cụ, hoá chất, chất chuẩn có bị nhiễm bẩn không. Nếu bị nhiễm bẩn, làm sạch dụng cụ thủy tinh bằng H2SO4loãng. Kiểm tra chất lượng nguồn nước của phòng thí nghiệm. Sử dụng hóa chất và chất chuẩn mới nếu thấy cần thiết.
- Mẫu lặp (LD: Laboratory Duplicate)
Phân tích ít nhất 01 mẫu lặp sau khi phân tích 20 mẫu hoặc một mẻ mẫu.
Mẫu lặp phải được lấy cùng từ một chai chứa mẫu
Phân tích mẫu LD1 và mẫu lặp LD2
Tính toán sự khác nhau của mẫu lặp bằng phương trình
Trong đó:
RPD = phần trăm sai khác
LD1 = mẫu lặp PTN, lặp lần thứ nhất
LD2 = mẫu lặp PTN, lặp lần thứ hai
Đánh giá sự khác nhau của mẫu lặp theo giới hạn RPD ± 20%.
Nếu % sai khác của mẫu lặp trong giới hạn, không có yêu cầu thêm nữa.
Nếu % sai khác của mẫu lặp nằm ngoài giới hạn RPD ± 20%, cán bộ phân tích phải báo với trưởng nhóm phân tích và trưởng nhóm phân tích phải báo cáo với quản lý chất lượng PTN về dữ liệu cuối cùng.
Trong trường hợp % sai khác của mẫu lặp ngoài giới hạn và kết quả mẫu gần với giới hạn phát hiện, việc tính toán sự khác nhau tuyệt đối như sau:
∆ = (LD1 – LD2)
Trong đó :
∆ = Sự khác nhau tuyệt đối
LD1 = mẫu lặp PTN, lặp lần thứ nhất
LD2 = mẫu lặp PTN, lặp lần thứ hai
- Đánh giá sự khác nhau của mẫu lặp theo giới hạn 0 ± 0,023 mg/L.
- Nếu ∆ nằm ngoài giới hạn 0 ± 0,023 mg/L, kết quả vẫn được báo cáo nhưng cán bộ phân tích có trách nhiệm thông báo với trưởng nhóm phân tích và và ghi lại những nhận xét trong “Biên bản thử nghiệm”.
-
- Mẫu thêm chuẩn (MS: Matrix Spike)
Phân tích 01 mẫu thêm chuẩn với nồng độ thêm là 0,2 mg/L sau khi phân tích 20 mẫu hoặc một mẻ mẫu.
Cách tiến hành: cho mẫu nền vào bình định mức 100ml nhưng không cho đến vạch, sau đó cho 2 ml dung dịch chuẩn (C = 10 mg/L) và định mức bằng mẫu nền cho đến vạch, lắc đều và phân tích như mẫu bình thường. (Lưu ý: Mẫu môi trường phải được điều chỉnh pH về môi trường trung tính trước khi thêm chuẩn hoặc phân tích)
Tính toán độ thu hồi theo phương trình
Trong đó:
R = Độ thu hồi
Cs = Nồng độ mẫu thêm chuẩn
C = Nồng độ của mẫu nền
S = Nồng độ đương lượng của chất phân tích thêm vào mẫu
- Đánh giá độ thu hồi mẫu thêm chuẩn dựa vào giới hạn 80 – 110%.
Nếu độ thu hồi nằm ngoài khoảng, các kết quả vẫn được báo cáo nhưng cán bộ phân tích phải báo với trưởng nhóm phân tích và sau đó trưởng nhóm phân tích phải báo cáo với quản lý chất lượng của PTN về số liệu cuối cùng. Hướng dẫn phân tích florua trong nước mặt